Cannabis

La planta de cannabis o cáñamo se conoce desde la antigüedad y crece en casi todas partes del mundo, pero se conoce principalmente como una fuente de fibra útil para la fabricación de textiles y cuerdas. En la mayoría de las áreas productoras de fibra, la planta no se usaba como droga. Los factores geográficos y climáticos modifican el contenido de material farmacológicamente activo en la planta, y solo en algunas regiones este contenido fue lo suficientemente alto como para llevar al descubrimiento de que la planta, y especialmente su resina, tuvieron importantes acciones farmacológicas. El conocimiento de estas acciones parece haber surgido primero en la región del Himalaya de Asia central y se extendió gradualmente desde allí a la India, Asia Menor, África del Norte y atravesó el desierto hasta el África subsahariana y el resto del continente africano.
En India, la planta se usó como medicina y en otras prácticas. Sus usos sociales y religiosos estaban relacionados principalmente con el festival de Durga Puja. En algunas otras ocasiones durante el año también se usó en celebraciones familiares, como matrimonios y nacimientos, para inducir un estado de ánimo relajado y social y un buen apetito. Solo se usaron las preparaciones más débiles: se tomó ‘bhang’ (comparable a la marihuana), y la preparación ligeramente más fuerte ‘ganja’ fue fumada, pero la preparación más potente, ‘charas’ (conocimiento en otras partes como hachís) no se usó para estos fines. , el uso de charas no fue socialmente aprobado para ningún propósito, y sus devotos fueron considerados como ‘malos personajes’ o marginados.
El cannabis también formaba parte del arsenal terapéutico de la medicina tradicional india, y muchos de los usos eran similares a los que actualmente se recomiendan en nuestra propia sociedad. Entre sus beneficios declarados se encuentran acciones sedantes, relajantes, ansiolíticas y anticonvulsivas, todo lo cual también lo hizo útil en el tratamiento del alcohol y la abstinencia de opiáceos: analgesia, estimulación del apetito, efectos antipiréticos y antibacterianos, y alivio de la diarrea.
La introducción de los efectos de la droga del cannabis en Europa en el siglo XIX siguió diferentes rutas para usos médicos y no médicos. En Francia, el interés se centró en la aplicación no médica de los efectos psicoactivos, mientras que en Inglaterra el interés fue principalmente médico. Durante la invasión napoleónica de Egipto en 1798, De Sacyand Rouyer, dos eruditos franceses que acompañaron al ejército, describieron la planta y la práctica y efectos del tabaquismo, y recolectaron muestras del material para llevar a Francia para su posterior estudio. El famoso psiquiatra francés Moreau de Tours hizo otras observaciones de sus efectos sobre el estado de ánimo durante sus viajes por el norte de África en la década de 1830. Más tarde describió en detalle los efectos mentales de altas dosis de hachís, y adelantó la hipótesis de que los sueños, la locura y la intoxicación por drogas implican mecanismos similares. Propuso el uso de hachís para producir una “psicosis modelo” para el estudio científico, un siglo antes de que este concepto se propusiera en América del Norte en relación con los alucinógenos dietilamida del ácido lisérgico y la mescalina. En París, el ‘Club des Haschichins ‘floreció en la década de 1850, con miembros como los poetas y los autores Baudelaire, Gautier y Dumas. Sirvieron a sujetos para los experimentos de Moreau y popularizaron el hachís en sus escritos como una ruta reclamada hacia la autorrealización estética, como lo hicieron Ginsberg y otros en los Estados Unidos durante un siglo más tarde.
En el Reino Unido, por otro lado, los escritos médicos y científicos de O’Shaughnessy, un médico británico que trabaja en India como profesor de Química y Materia Médica en Calcuta, despertaron el interés en el cannabis y observó el uso del cannabis en India. medicina tradicional, para el tratamiento de trastornos espásticos y convulsivos como ‘hidrofobia’ (rabia), tétanos, cólera y delir-ium tremens. Envió suministros del material a una empresa farmacéutica en Londres para su análisis y ensayos clínicos. Los extractos de cannabis fueron adoptados en la Farmacopea Británica y más tarde en la Farmacopea Americana, y fueron ampliamente utilizados en el mundo de habla inglesa como agentes sedantes, hipnóticos y anticonvulsivos a fines del siglo XIX y principios del XX.
Sin embargo, cuando se eliminó el cannabis de la Farmacopea Británica en 1932 y de la Farmacopea Americana en 1941, su uso clínico prácticamente había desaparecido y su destierro formal provocó poca o ninguna protesta. Una de las razones de esta pérdida de favor fue que el material vegetal era de composición demasiado variable, su vida útil era demasiado corta e impredecible, y había sido reemplazado cada vez más por opiáceos puros y nuevas drogas sintéticas más confiables inventadas en la primera parte del siglo 20. Por lo tanto, el cannabis tendría que ser mejorado sustancialmente como una droga para recuperar el interés clínico.
Estudios químicos antiguos y modernos.
En el norte de África se conocía la muy alta solubilidad en lípidos de los materiales responsables de los efectos del cannabis en el uso de drogas, donde una práctica común era calentar las hojas y la parte superior de la planta en una mezcla de mantequilla y agua. Los medicamentos activos se concentraron en la fase de la mantequilla y, a medida que la mezcla se enfriaba, la mantequilla podía separarse del agua y usarse en preparaciones para tomar por la boca para producir los efectos deseados. En 1857, los Hermanos Hermanos de Edimburgo prepararon una fracción no alcaloide con un alto nivel de actividad farmacológica, y los extractos alcohólicos o los residuos secos obtenidos a partir de ellos se estandarizaron posteriormente para su actividad biológica, formando la base de las preparaciones farmacopeoidales. En 1899, Wood, Spivey y Easterfield intentaron aislar a los agentes activos de tales preparaciones, pero su “cannabinol” tenía muy poca actividad farmacológica y resultó ser una mezcla en lugar de un solo compuesto.
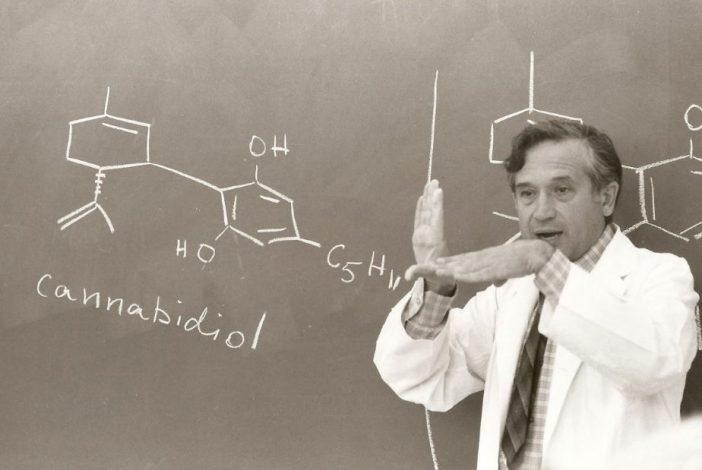
No fue sino hasta la década de 1930 y 1940 que Todd et al en el Reino Unido y Adams et. al. en los Estados Unidos aislaron cannabidiol puro y varios tetrahidrocannabinoles (THC), y demostraron que estos últimos eran responsables por los efectos psicoactivos. De los numerosos compuestos químicos aislados del cannabis, solo tres tienen los efectos psicoactivos típicos para los cuales el cannabis se usa de forma no médica: ∆9-THC, ∆8-THC y (muy débilmente) cannabinol. Un cuarto cannabinoide natural, el cannabidiol, tiene otros tipos de actividad farmacológica pero no es psicoactivo.
Finalmente, Mechoulam et al en Israel, y Claussen y Korte en Alemania lograron la síntesis completa de los compuestos puros, establecieron sus estructuras moleculares y desarrollaron el estudio de sus relaciones estructura-actividad. Este trabajo condujo a la síntesis de nuevos derivados de cannabinoides y análogos que no existen en la naturaleza. Armados con estos químicos puros y potentes, Devane et al identificaron sitios de unión específicos (receptores de cannabinoides) en el cerebro, y demostraron las afinidades de unión al receptor de los diferentes compuestos paralelos a sus respectivas potencias de actividad biológica.
Debido a que los cannabinoides en sí mismos no existen en el cerebro, la existencia de los receptores implica que otros materiales endógenos en el cerebro normalmente se unen a ellos. Los químicos Lumir Hanus y William Devane informaron más tarde el aislamiento de la anandamida (araquidonil-etanolamina), un material lipídico relacionado con las prostaglandinas, que se forma localmente en el cerebro y se une a los receptores, ejerciendo acciones similares a las de los cannabinoides pero menos potentes. El araquidonil-glicerol y varios otros materiales similares se han identificado posteriormente.
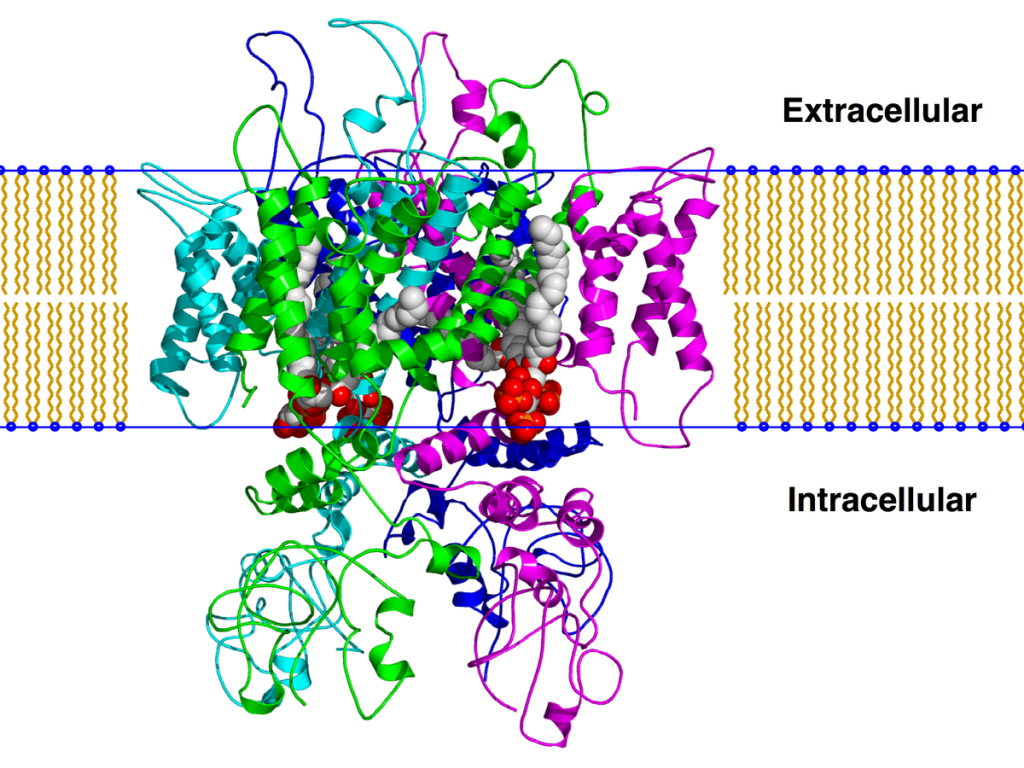
Se encontró que los receptores cannabinoides eran de al menos dos tipos diferentes, los receptores CB1 están presentes principalmente en varias partes del cerebro (corteza cerebral, cerebelo, ganglios basales, sistema límbico, hipotálamo, hipocampo) y los receptores CB2 presentes exclusivamente en tejidos periféricos como el sistema inmune, médula ósea, pulmón, pancreas y músculo liso. Ambos tipos de receptores están unidos a la proteína G inhibidora, a través de la cual actúan inhibiendo la actividad de la ciclasa, evitando la activación de diversos canales de iones de calcio en la membrana celular, mientras que aumentan la entrada de iones de potasio. Los resultados funcionales varían en diferentes tipos de neuronas. Las neuronas inhibitorias se activan, con una mayor liberación de GABA, mientras que las neuronas motoras, la excitabilidad celular y la liberación de neurotransmisores disminuyen. El aislamiento de los diferentes tipos de receptores ha permitido desarrollar compuestos totalmente sintéticos con alta afinidad selectiva por uno u otro tipo, algunos actuando como agonistas y otros como antagonistas. La disponibilidad de estos ligandos específicos del receptor ha permitido avances rápidos en el análisis de los mecanismos celulares que subyacen a los diversos efectos farmacológicos de los cannabinoides.
Al examinar una flor de cannabis, notará un nudo complejo de diferentes partes: los pelos anaranjados ardientes, los cristales azucarados, las protuberancias gruesas envueltas en pequeñas hojas. Pero, ¿qué son exactamente estas formaciones y qué funciones cumplen?




Esta breve guía de la anatomía del cannabis está destinada a familiarizarlo con la planta en su forma completa.
Plantas masculinas y femeninas


Las plantas de cannabis pueden ser masculinas, femeninas o ambas (hermafrodita), pero lo que hay ahora en su recipiente son las flores de una hembra.
Las plantas femeninas producen las grandes flores secretoras de resina que se recortan en brotes redondos o puntiagudos, mientras que los machos producen sacos de polen más pequeños cerca de la base de las hojas. Las plantas masculinas polinizan a las hembras para iniciar la producción de semillas, pero las potentes flores que consumimos provienen de las plantas femeninas sin semillas, llamadas sinsemilla, que producen grandes cogollos ricos en cannabinoides sin semillas.
Las plantas hermafroditas raras contienen órganos sexuales femeninos y masculinos que permiten que la planta se polinice durante la floración. Esta autopolinización generalmente se considera una molestia entre los productores, ya que estropea las plantas sinsemilla sin semillas y transmite genes hermafroditas.
Los productores pueden asegurar el sexo de sus plantas cultivando clones o los recortes genéticamente idénticos de una cepa original. Las semillas feminizadas también están disponibles a través de un proceso de mejoramiento especial.
La planta de cannabis se compone de varias estructuras, muchas de las cuales podemos encontrar en cualquier especie de floración común. El cannabis crece en tallos largos y delgados con sus grandes e icónicas hojas de abanico que se extienden desde áreas llamadas nodos. El cannabis realmente comienza a destacarse en sus flores, donde se producen formaciones únicas e intrincadas.
Cola


Una cola se refiere a un grupo de brotes que crecen muy juntos. Mientras que las colas más pequeñas ocurren a lo largo de los sitios de florecimiento de las ramas inferiores, la cola principal (a veces llamada brote apical) se forma en la parte superior de la planta.
Estigma y pistilo


El pistilo contiene las partes reproductivas de una flor, y los filamentos vibrantes, parecidos al cabello, se llaman estigmas. Los estigmas sirven para recoger el polen de los machos. Los estigmas del pistilo comienzan con una coloración blanca y se oscurecen progresivamente a amarillo, naranja, rojo y marrón a lo largo de la maduración de la planta. Desempeñan un papel importante en la reproducción, pero los estigmas aportan muy poco a la potencia y al sabor de la flor.
Brácteas y cáliz
Una bráctea es lo que encapsula las partes reproductivas de la hembra. Aparecen como “hojas” verdes en forma de lágrima, y están fuertemente cubiertas de glándulas de resina que producen la mayor concentración de cannabinoides de todas las partes de la planta. Encerrado por estas brácteas e imperceptible a simple vista, el cáliz se refiere a una capa translúcida sobre el óvulo en la base de una flor.
Tricoma
A pesar de su tamaño diminuto, es difícil pasar por alto la manta de resina de cristal en un brote de cannabis. Esta resina (o “kief” cuando está seca) se secreta a través de glándulas translúcidas en forma de hongo en las hojas, tallos y cálices. Los tricomas se desarrollaron originalmente para proteger la planta contra los depredadores y los elementos. Estos globos bulbosos transparentes rezuman aceites aromáticos llamados terpenos, así como cannabinoides terapéuticos como el THC y el CBD. La base de la producción de hachís depende de estos tricomas y de su potente resina similar al azúcar.
Las palabras “indica” y “sativa” se introdujeron en el siglo XVIII para describir diferentes especies de cannabis: Cannabis sativa y Cannabis indica. El término sativa describe las plantas de cáñamo que se encuentran en Europa y el oeste de Eurasia, donde se cultivaba por su fibra y semillas. El cannabis indica se refiere a las variedades psicoactivas descubiertas en la India, donde fue cosechado para sus semillas, fibra y producción de hachís.
Aunque las variedades de cannabis que consumimos provienen en gran medida de Cannabis indica, ambos términos se usan, aunque sea erróneamente, para organizar las miles de cepas que circulan hoy en el mercado.
Así es como los términos han cambiado desde sus primeras definiciones botánicas:
- Hoy, “sativa” se refiere a variedades altas de cannabis de hoja estrecha, que se cree que inducen efectos energizantes. Sin embargo, estas variedades de drogas de hoja estrecha fueron originalmente Cannabis indica ssp. Indica.
- “Indica” ha llegado a describir plantas robustas de hoja ancha, que se cree que producen efectos sedantes. Estas variedades de drogas de hoja ancha (BLD) son técnicamente Cannabis indica ssp. Afganica
- Lo que llamamos “cáñamo” se refiere a las variedades industriales no intoxicantes cosechadas principalmente para fibra, semillas y CBD. Sin embargo, esto originalmente se llamaba Cannabis sativa.
Con la comercialización masiva del cannabis, las distinciones taxonómicas entre las especies y subespecies de cannabis se volvieron de cabeza y se calcificaron. Pero ahora sabemos que una cepa tiene más que su designación índica, sativa o híbrida.
Cannabis híbrido
Las cepas híbridas, se crían a partir de plantas descendientes de índica y sativa. Debido a la larga historia de cruces de variedades de cannabis, muchas de ellas históricamente hechas bajo tierra para evadir a las autoridades, las variedades que tienen linajes puramente indica o sativa son realmente raras. La mayoría de las cepas denominadas “indica” o “sativa” son, de hecho, híbridos, con genética heredada de ambas subespecies.


Tanto el THC como el CBD se consideran los cannabinoides más conocidos. Hay cientos de cannabinoides en el cannabis y actualmente ya se han clasificado más de 65 cannabinoides. En total, hay más de 480 componentes naturales dentro de la planta de cannabis.


El THC (tetrahidrocannabinol) es la parte de la planta de cannabis que produce un subidón mental y corporal. Tiene efectos que alteran la mente. El THC funciona uniéndose a los receptores cannabinoides naturales del cerebro, que crean una sensación de euforia. Muchas personas consumen THC a través de aceites, cápsulas, flores y comestibles.
El CBD es muy diferente. El CBD no produce un efecto alterador y se usa para tratar muchas dolencias diferentes. El CBD proviene de plantas de cáñamo y cannabis. Los productos se crean extrayendo los aceites de CBD de la planta y convirtiéndolos en un gel, gominolas, aceite o suplemento.
En términos generales, el CBD y el THC ayudan a tratar enfermedades y trastornos médicos. Grandes dosis de THC pueden tener algunos efectos secundarios negativos, mientras que los grandes consumos de CBD son generalmente seguros, ya que no es una alteración mental.
El CBD puede ayudar a tratar la ansiedad de su ser querido peludo y ayudarlos a calmarse cuando están estresados. Puede darles CBD obteniendo golosinas, aceites y gotas de agua.
Según los estudios, cualquier CBD que sea seguro para el consumo humano también debería ser seguro para las mascotas y los niños. Sin embargo, solo un número limitado de veterinarios en realidad recomiendan CBD para perros, ya que hay un número limitado de estudios. Todavía hay que hacer más estudios para ver si puede funcionar tanto con los gatos como con los perros.
Terpenos del Cannabis


Los cannabinoides y los terpenos tienen muchas diferencias. Los terpenos son aceites esenciales naturales que controlan cómo huelen y saben las cosas. ¡Los has estado experimentando toda tu vida!
Existen al menos 20,000 terpenos diferentes y la planta de cannabis contiene más de 100 de ellos.
Ambas plantas Indica y Sativa tienen terpenos. Estos terpenos ayudan a determinar qué planta o cepa tienes. Los tipos de terpenos dentro de las plantas pueden incluso decirle si es una Sativa, Indica o híbrida.
Uno de los terpenos más importantes para conocer es el mirceno. Este terpeno tiene propiedades antiinflamatorias y sedantes. Cualquier cepa que tenga más del 0,5% de mirceno se considera Indica, debido al efecto sedante del mirceno cuando se combina con THC.
Las plantas sativas contienen menos mirceno y, a veces, altos niveles de pineno. El pineno también tiene propiedades antiinflamatorias, pero también aumenta su estado de ánimo.
El terpeno humuleno es bueno para las personas que desean disminuir su apetito y beneficiarse de las propiedades antibacterianas.
El terpeno Cariofileno puede hacer que su marihuana tenga un aroma picante o picante. Este terpeno puede beneficiar a las personas que experimentan ansiedad, depresión e inflamación.
El terpeno Linalool es el mejor para aquellos que desean una experiencia relajante y de alivio del estrés. Este terpeno en realidad puede ayudar a reducir la ansiedad por el THC.
Como se mencionó anteriormente, los terpenos controlan la forma en que percibimos el gusto y el olfato. Muchas veces, las personas seleccionan su variedad favorita por el sabor u olor de la flor. Si sabe qué terpenos son dominantes en esa cepa, podrá encontrar fácilmente otras cepas con ese mismo perfil.